La biopsia líquida determina cómo y cuándo tratar una metástasis cerebral de forma personalizada
Las metástasis cerebrales son el tumor más común del cerebro y una complicación devastadora de cánceres como el de pulmón, melanoma y mama. Su heterogeneidad y su difícil localización hacen que el manejo de estos pacientes sea muy complejo.
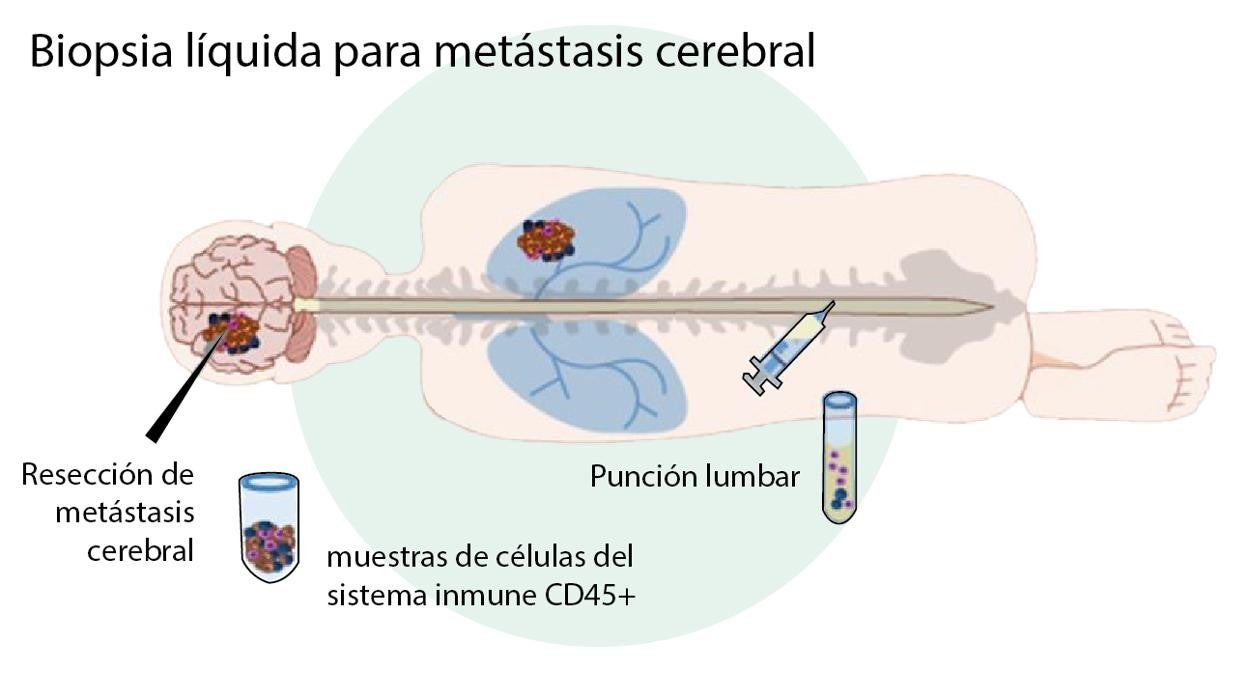
Basta una simple punción lumbar para obtener las células del sistema inmune y predecir si una persona con metástasis cerebral va a responder o no al tratamiento con inmunoterapia.
La clave está, según un estudio publicado en la revista « Nature Communications », en que las ... células del sistema inmune presentes en el líquido cefalorraquídeo -fluido que riega el cerebro- tienen características similares a las de las células que se encuentran en las metástasis cerebrales. Su estudio, señala Joan Seoane, director de Investigación Traslacional y Preclínica del Vall d’Hebron Instituto de Oncología (VHIO), de permite establecer biomarcadores de respuesta al tratamiento con inmunoterapia y, además, «podemos monitorizar el tratamiento ya que, en muchas ocasiones con el tiempo, el tumor genera resistencias y se escapa a la terapia. Ahora ya podemos identificar precozmente las resistencias y adaptar el tratamiento en función ».
La metástasis cerebral es la más agresiva y la que conlleva peor pronóstico. Melanoma, cáncer de pulmón y de mama tienen tendencia a diseminarse en el cerebro y, aunque se ha demostrado que algunos tratamiento de inmunoterapia ( inhibidores del punto de control inmune) son eficaces para controlar algunos tumores de pulmón y melanoma, «el problema del cáncer es su heterogeneidad. Cada tumor es diferente, las células que forma cada tumor son distintas y, además, en el caso de metástasis, las lesiones puede ser diferentes, lo que dificulta no solo su diagnóstico, sino su tratamiento y monitorización».
Esta ‘prueba de concepto’ permite conocer las características de la metástasis cerebral en cada instante y así ofrecer el tratamiento más adecuado
Se sabe, asegura Seone, que estas nuevas lesiones no solo pueden ser muy distintas del tumor primario, sino comportarse de una manera diferente ante la inmunoterapia. Además, « la localización de estas lesiones limita el acceso al material tumoral para caracterizar el cáncer », explica Seoane.
Esta ‘prueba de concepto’, destaca el investigador, «viene a cubrir una necesidad». Es decir, señala Seone, «nos permite conocer las características de la metástasis cerebral en cada instante y así ofrecer el tratamiento más adecuado».
Se trata de medicina personalizada o de precisión , con una implicación clínica clara y directa» ya que se podría aplicar el tratamiento más efectivo para la metástasis cerebral, y no ir «a ciegas, como ocurre actualmente en muchas ocasiones debido a la imposibilidad de caracterizar el tumor».
Seoane y su equipo analizaron muestras de 48 pacientes con metástasis cerebrales obtenidas en el Hospital Universitario Vall d’Hebron y en el Hospital Clínic de Barcelona . Analizaron las células del sistema inmune que se encontraban en las metástasis cerebrales y las células del sistema inmune presentes en el líquido cefalorraquídeo. « Necesitábamos saber qué tipos de células había en el líquido cefalorraquídeo y compararlas con las obtenidas de las lesiones metastásicas. Si los resultados eran similares, significaba que habíamos desarrollado un método no invasivo que nos permitiría predecir la respuesta a los tratamientos de inmunoterapia», subraya Seoane.
Así, mediante una punción lumbar, como se hace con la epidural, se obtienen la muestra del líquido cefalorraquídeo.
Los investigadores estudiaron todas las células del sistema inmune que se encontraban tanto en las lesiones cerebrales como en el líquido cefalorraquídeo obtenido en diferentes momentos del tratamiento.
Gracias a la tecnología de última generación scRNA-seq del grupo de Genómica de Células Individuales del CNAG-CRG se pudo realizar la secuenciación del ARn - célula a célula - de forma individualizada de unas 6.000 células.
Demostramos que la secuenciación del receptor de células T proporciona un código de barras celular que puede evaluarse fuera del tumor, lo que abre nuevas vías para la detección del cáncer de forma más sistemática
La información que obtenemos nos ayuda a obtener marcadores de respuesta a la inmunoterapia. Esto es la primera vez que se ve en el mundo
«La secuenciación transcriptómica individualizada proporciona una alta resolución sin precedentes para la detección y el seguimiento de varios tipos de enfermedades. La identificación de los clones de células T tanto en la metástasis como en la biopsia líquida es de particular interés. Demostramos que la secuenciación del receptor de células T proporciona un código de barras celular que puede evaluarse fuera del tumor, lo que abre nuevas vías para la detección del cáncer de forma más sistemática», explica Holger Heyn , jefe de grupo en el CNAG-CRG y coautor del estudio que ha contado con el apoyo de la AECC y la Fundación BBVA.
«La información que obtenemos nos ayuda a obtener marcadores de respuesta a la inmunoterapia. Esto es la primera vez que se ve en el mundo», asegura Seoane.
Los investigadores se encuentran actualmente simplificando este sistema e identificando marcadores más sencillos para no tener que hacer una secuenciación individualizada de células. « Estamos estudiando y comprobando que bastaría con medir únicamente las cantidad de células T CD8 », adelanta.
Y concluye este profesor ICREA, «necesitamos hacer otra cohorte de pacientes con más casos para demostrar el beneficio de esta aproximación. Una vez ultimado estos pasos, se podrá incorporar a la práctica clínica, siempre en aquellos centros que tengan la tecnología para hacerlo con marcadores más sencillo».
Esta funcionalidad es sólo para suscriptores
Suscribete
Esta funcionalidad es sólo para suscriptores
Suscribete