Descubren cómo una de las bacterias más peligrosas del mundo consigue infectar los pulmones
Se trata de un patógeno muy temido que causa neumonía grave y potencialmente mortal
Josep Tabernero, oncólogo: «Llevo diez años sin tomar antibióticos para cuidar mi microbioma»
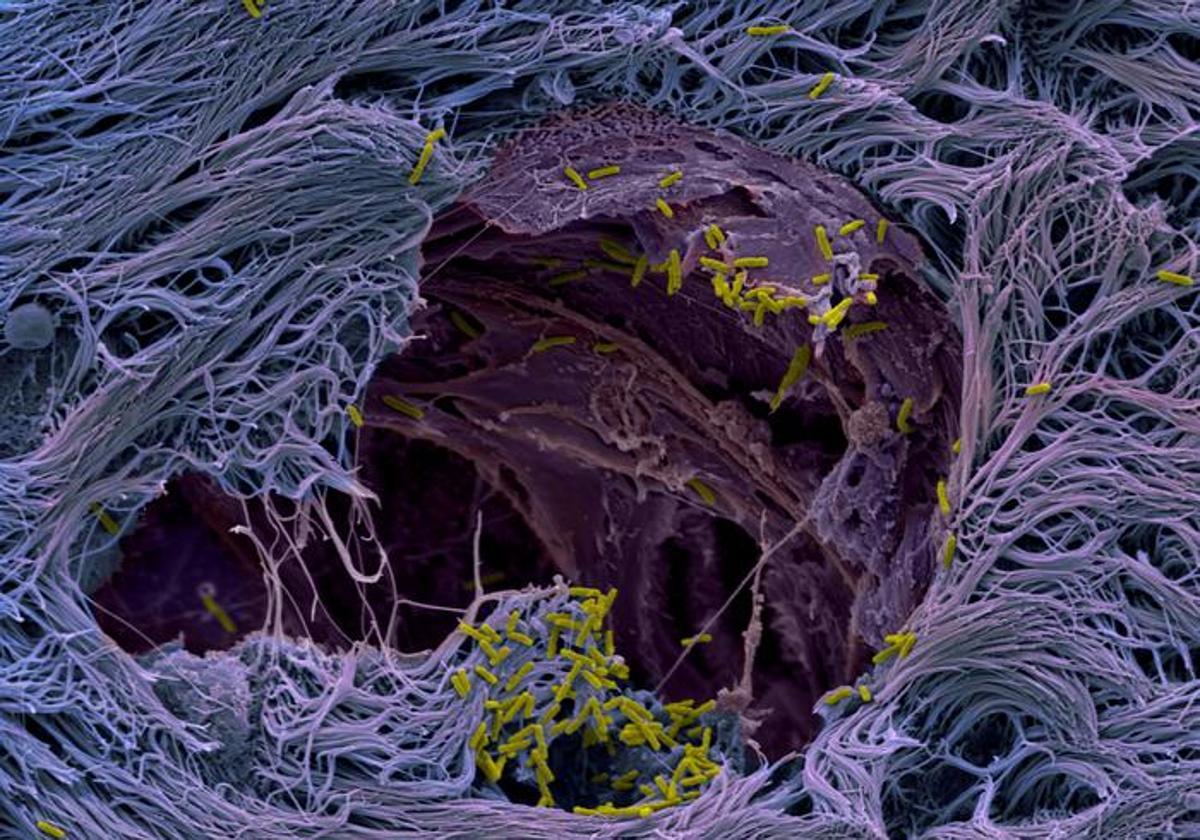
Un equipo del Biozentrum de la Universidad de Basilea ha descubierto la estrategia utilizada por un peligroso patógeno, utilizando microtejidos de pulmón humano. La bacteria se dirige a células pulmonares específicas y ha desarrollado una estrategia sofisticada para atravesar la línea de defensa de los pulmones. Los resultados se publican en la revista científica 'Nature Microbiology'.
La OMS publicó este año una lista de los patógenos bacterianos más peligrosos del mundo que son resistentes a múltiples antibióticos y representan una grave amenaza para la salud humana. Esta lista incluye Pseudomonas aeruginosa, un patógeno nosocomial muy temido que causa neumonía grave y potencialmente mortal. Este patógeno es especialmente amenazante para los pacientes inmunocomprometidos y aquellos que reciben ventilación mecánica, con tasas de mortalidad de hasta el 50 por ciento.
Pseudomonas aeruginosa ha desarrollado una amplia gama de estrategias para invadir los pulmones y el cuerpo. Investigadores dirigidos por el profesor Urs Jenal, del Biozentrum de la Universidad de Basilea, han obtenido nuevos conocimientos sobre el proceso de infección utilizando microtejidos pulmonares cultivados en laboratorio y generados a partir de células madre humanas. Los autores describen cómo Pseudomonas atraviesa la capa superior del tejido pulmonar e invade zonas más profundas.
Nuestros pulmones están revestidos por una fina capa de células apretadas que protegen las capas más profundas del tejido pulmonar. La superficie está cubierta de moco, que atrapa partículas como microorganismos, y es eliminado de las vías respiratorias por células especializadas. Esta capa sirve como una barrera eficaz casi impenetrable contra patógenos invasores. La bacteria Pseudomonas ha encontrado una manera de romperla, pero hasta ahora seguía siendo un misterio cómo el patógeno cruza la barrera tisular.
«Hemos cultivado microtejidos de pulmón humano que imitan de manera realista el proceso de infección dentro del cuerpo de un paciente. Estos modelos pulmonares nos permitieron descubrir la estrategia de infección del patógeno. Utiliza las células caliciformes productoras de moco como caballos de Troya para invadir y cruzar la barrera del tejido. Al atacar las células caliciformes, que constituyen sólo una pequeña parte de la mucosa pulmonar, las bacterias pueden romper la línea de defensa y abrir la puerta«, explica Jenal.
Con un gran arsenal de factores de virulencia, conocidos como sistemas de secreción, el patógeno ataca e invade específicamente las células caliciformes, se replica dentro de las células y finalmente las mata. La explosión de las células muertas provoca roturas en la capa de tejido, lo que hace que la barrera protectora se vuelva permeable. Los patógenos aprovechan este punto débil: colonizan rápidamente los sitios de ruptura y se propagan a regiones de tejido más profundas.
Los científicos han podido dilucidar las sofisticadas estrategias de infección de Pseudomonas utilizando organoides pulmonares humanos. Sin embargo, no está claro cómo los patógenos adaptan su comportamiento durante el proceso de infección. Por ejemplo, primero deben ser móviles para extenderse por la superficie del tejido, luego adherirse rápidamente a las células pulmonares al entrar en contacto y luego activar sus factores de virulencia. Se sabe que las bacterias pueden cambiar rápidamente su comportamiento gracias a pequeñas moléculas de señalización. Sin embargo, hasta ahora no se disponía de la tecnología necesaria para estudiar estas correlaciones.
El equipo de Jenal ha desarrollado un biosensor para medir y rastrear una pequeña molécula de señalización llamada c-di-GMP en bacterias individuales. El método fue descrito recientemente en 'Nature Communications'. «Se trata de un avance tecnológico. Ahora podemos monitorear en tiempo real y con alta resolución cómo se regula esta molécula de señalización durante la infección y cómo controla la virulencia del patógeno. Tenemos una vista detallada de cuándo y dónde las células bacterianas individuales activan ciertos programas para regular su comportamiento. Este método nos permite investigar las infecciones pulmonares con más detalle», afirma Jenal.
Los organoides del pulmón humano y de otros órganos como la vejiga permiten a los investigadores estudiar los efectos de los antibióticos en los tejidos, identificando, por ejemplo, dónde y cómo sobreviven las bacterias durante el tratamiento. Estos modelos de órganos serán indispensables en el futuro para desarrollar estrategias nuevas y eficaces para combatir los patógenos. «Gracias al desarrollo de organoides pulmonares humanos, ahora comprendemos mucho mejor cómo se comportan los patógenos en el tejido humano y, presumiblemente, en los pacientes», concluye Jenal.
Esta funcionalidad es sólo para suscriptores
Suscribete
Esta funcionalidad es sólo para suscriptores
Suscribete